里程碑|宇耀生物首个创新药临床(IND)获批
2022-03-03
2022年3月3日,宇耀生物自主研发的新一代EP4受体小分子拮抗剂YY001临床试验申请正式获得国家药品监督管理局(NMPA)批准,同意针对晚期实体肿瘤开展1期临床试验。这是宇耀生物获得的中国首个IND批件,该靶点全球尚无同类药物上市,其1期临床即将在上海市东方医院开展。
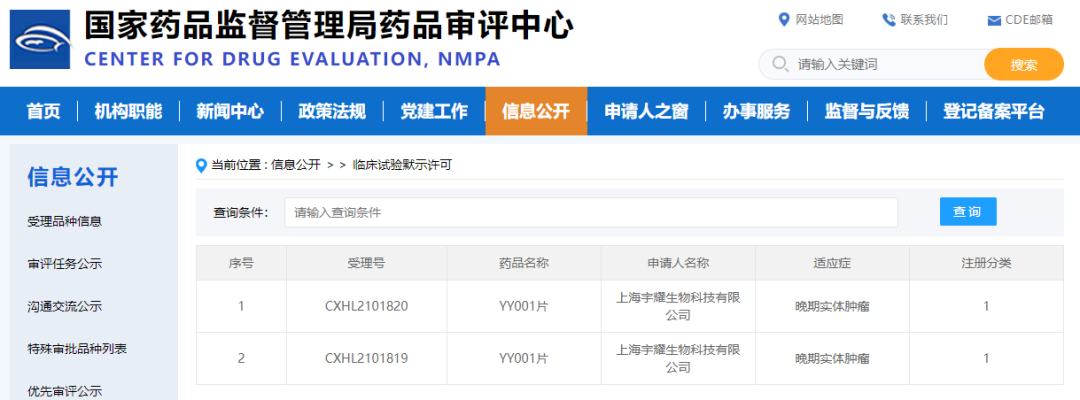

YY001是宇耀生物自主研发的新一代EP4受体小分子拮抗剂,临床前药效研究显示其在结直肠癌、胃癌和前列腺癌等晚期实体肿瘤中表现出显著的抗肿瘤作用,并且在和PD-1抗体联用时显著增强治疗效果,有望将PD-1抗体治疗不敏感的冷肿瘤转变为热肿瘤,为晚期实体瘤的治疗提供新的策略,造福更多的中国乃至全球晚期癌症患者[1,2]。
宇耀生物CEO周文波博士表示:
“YY001的提前获批是公司与CDE监管部门充分沟通、协力合作的结果,也充分表明了CDE对公司临床前数据的高度认可。YY001是国内原研首个靶向EP4的新药临床批件,目前该靶点尚无同类药物上市。宇耀生物作为国内首家获批的具有全球知识产权的临床批件,填补了该领域国内的空白。YY001的获批是宇耀生物全球顶尖科学家与资深工业化团队科研成果转化的典范,今年我们还将有多个中美临床批件的获批。”
宇耀生物董事长刘明耀博士表示:


